Page 180 - kpiebook65064
P. 180
130 โครงการสังเคราะห์ข้อเสนอ
เพื่อเสริมสร้างการอภิบาลระบบยา
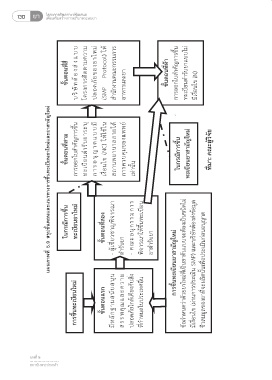
แผนภาพที่ 5.10 ขั้นตอนการขึ้นทะเบียนต ารับยาสามัญใหม่ (New Generic Drugs)
บ ช่องทางที่ 1ช่องทางปกติ (Standard Review)
บ
แ ง Protocol) ให้
ขั้นตอนที่สี่ ส่ ง อ ต้ โครงการติดตามความ ปลอดภัยของยาใหม่ ส านักงานคณะกรรมการ ขั้นตอนที่ห้า การออกใบส าคัญการขึ้น ทะเบียนต ารับยาแบบไม่ ยื่นค าขอขึ้นทะเบียนยา (ท.ย.1)
เป็นประโยชน์ต่อผู้ผลิตยาสามัญและผู้บริโภค เนื่องจากท าให้ลดการผูกขาดยาคือเมื่อยาต้นแบบพ้น SMP
วิธีการควบคุมคุณภาพยา รวมไปถึงฉลาก เอกสารการก ากับยา เป็นด้นโดยช่องทางพิเศษใช้เวลา
Review)ซึ่งด าเนินการโดยผู้เชี่ยวชาญเพื่อพิจารณาสูตร วิธีการผลิต
และวิธีการควบคุมคุณภาพยา รวมไปถึงฉลาก เอกสารการก ากับยา เป็นด้น โดยช่องทางปกติใช้
บริษัทที่จะผลิตยาสามัญในประเทศมีสิทธิยื่นเสนอการทดสอบชีวสมมูลก่อนยาต้นแบบครบก าหนด SMP ได้ซึ่ง
ต้นแบบจะต้องเป็นชนิดไม่มีเงื่อนไข (ผ่านการประเมิน SMP แล้ว) และบริษัทต้องส่งข้อมูลชีวสมมูลของยาที่จะ
ผลิตนั้นด้วยตามแผนภาพ 5. เพื่อประเมินก่อนอนุญาตอย่างไรก็ดีพ.ศ.2544 คณะกรรมการยาได้อนุมัติให้
อันตราถึงชีวิต โดยการพิจารณาด าเนินการโดยผู้เชี่ยวชาญเพื่อพิจารณาสูตร วิธีการผลิต และ
ความจ าเป็นเร่งด่วนในการแก้ไขปัญหาสาธารณสุขของประเทศ หรือยารักษาโรคร้ายแรงที่เป็น
กรณียาสามัญใหม่ซึ่งบริษัทที่ต้องการผลิตยาชนิดเดียวกันกับยาใหม่ มีข้อก าหนดว่ายาใหม่ที่เป็นยา
ช่องทางเร่งด่วน (Accelerated or Priority Review) ซึ่งเป็นการขึ้นทะเบียนต ารับยาใหม่ที่มี
2 ส านักงานคณะกรรมการอาหารและยา. (ม.ป.ป.). คู่มือการขึ้นทะเบียนต ารับยาสามัญใหม่ [ออนไลน์]. สืบค้นเมื่อวันที่ 3
ษั ท อาหารและยา มีเงื่อนไข (N) 10 วันท าการ
ในการขึ้นทะเบียนต ารับยาที่เป็นยาสามัญใหม่จะมีขั้นตอนเดียวกับยาใหม่เกือบทุกขั้นตอน
แผนภาพที่ 5.9 สรุปขั้นตอนและแนวทางการขึ้นทะเบียนยาใหม่และยาสามัญใหม่
ริ (SMP
บ ตรวจสอบเอกสารและลงเลขรับ ค าขอ
แผนภาพที่ 5.9 สรุปขั้นตอนและแนวทางการขึ้นทะเบียนยาใหม่และยาสามัญใหม่
การขึ้นทะเบียนต ารับยาที่เป็นยาสามัญใหม่ (New Generic Drug)
มี
ติดต่อประสานงานจัดเตรียมต ารับและเอกสาร
บ
ขั้นตอนที่สาม การออกใบส าคัญการขึ้น ทะเบียนต ารับยาระบุ บ แ ต า ญ นุ อ ร า เงื่อนไข (NC) ให้ใช้ใน สถานพยาบาลภายใต้ การควบคุมของแพทย์ เท่านั้น ในกรณีการขึ้น ทะเบียนยาสามัญใหม่ ที่มา: คณะผู้วิจัย สรุปข้อมูลเบื้องต้นน าส่งผู้เชี่ยวชาญ 20 วันท าการ
กระบวนการขึ้นทะเบียนต ารับยาใหม่แบ่งออกเป็นสองช่องทางคือ
60 วันท าการ
ก
การขึ้นทะเบียนต ารับยาแบบชนิดไม่มีเงื่อนไข
กระบวนการขึ้นทะเบียนต ารับยาสามัญใหม่
5-16 ผู้เชี่ยวชาญส่งผลการประเมินกลับมาที่ อย. 10 วันท าการ
ร
แจ้งผลต่อผู้ประกอบการ
า
ในกรณีการขึ้น ทะเบียนยาใหม่ ขั้นตอนที่สอง - ผู้เชี่ยวชาญพิจารณา ต ารับยา ม ร ร ก นุ อ ะ ณ พิจารณาให้ขึ้นทะเบียน ยาต ารับยา มีนาคม 2556 จาก http://drug.fda.moph.go.th/zone_service/files/drog(d01-05).pdf ไม่รับพิจารณา รับ แก้ไข/ส่ง
ก
ช่องทางปกติ (Standard เวลา 110 วันท าการตามแผนภาพที่5.10 70 วันท าการตามแผนภาพที่ 5.11 2 ผู้ผลิตยาสามัญในประเทศก็สามารถผลิตได้ทันที นุน ม า ว ค - ค การขึ้นทะเบียนยาสามัญใหม่ ข้อก าหนดว่าด้วยยาใหม่ที่เป็นยาต้นแบบจะต้องเป็นชนิดไม่ มีเงื่อนไข (ผ่านการประเมิน SMP) และบริษัทต้องส่งข้อมูล ชีวสมมูลของยาที่จะผลิตนั้นเพื่อประเมินก่อนอนุญาต แจ้งผู้ประกอบการ ออกเลขทะเบียน 10 วันท าการ
เอกสาร
เพิ่มเติม
5.2.3 - 1. 2. - การขึ้นทะเบียนใหม่ ขั้นตอนแรก มีหลักฐานสนับส ะ ล แ ณ คุ พ ร ปลอดภัยใกล้เคียงกับสิ่ง ที่ก าหนดในประเทศอื่น และรับใบส าคัญ รวมเวลา 110 วันท าการ
ที่มา: ส านักงานคณะกรรมการอาหารและยา. (ม.ป.ป.). คู่มือการขึ้นทะเบียนต ารับ
ร
ส
ยาสามัญใหม่, [ออนไลน์]. หากไม่มีการแก้ไขและ Bioequivalence
report ได้รับอนุมัติแล้ว
http://drug.fda.moph.go.th/zone_service/files/drog(d01-05).pdf 04).pdf
บทที่ 5 5-17
สถาบันพระปกเกล้า